Structure de l'atome
Fondamental :
Un atome est constitué d'un noyau et d'électrons
Définition : L'électron
 Electron | Tous les électrons sont identiques. Leur nombre diffère en fonction de la nature de l'atome. Un électron a une charge négative (-1). |
Définition : Le noyau
 Noyau | Au centre de l'atome, le noyau est différent pour tous les atomes. Il a une charge positive dont la valeur dépend du nombre d'électrons. |
Définition : Les charges électriques
Les charges de nature opposée s'attirent (+ -). Les électrons restent autour du noyau grâce à cette attraction. Les charges de même nature se repoussent (++ ; - -). |  Attraction noyau-électron |
Définition : L'atome
Exemple :
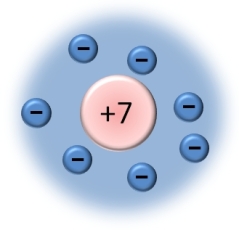 Atome d'azote | Ici, on compte 7 électrons. Cet atome possède donc 7 charges négatives. Pour les compenser, le noyau possède 7 charges positives. |
Grâce au tableau périodique, on peut déterminer la nature de l'atome en fonction du nombre d'électrons. Le nombre d'électrons est nombre le plus petit inscrit dans la case de l'atome. Ici, l'atome possède 7 électrons : c'est un atome d'azote. |